특허법원 2017. 12. 21. 선고 2016허9035 판결【거절결정(특)】[각공2018상, 156]
- 조회수
- 183
- 작성일
- 2018.03.19
판결요지
명칭이 “9-시스 레티노산의 제조 방법”인 특허발명의 특허권자인 영국 甲 제약 주식회사가 특허발명을 실시하기 위한 의약품 ‘알리톡연질캡슐10밀리그램’의 구 약사법(2013. 7. 30. 법률 제11985호로 개정되기 전의 것, 이하 같다)에 따른 품목허가를 받는 데 458일이 소요되었다며 특허권의 존속기간 연장등록출원을 하였으나, 특허청이 위 의약품이 구 약사법 제2조 제8호 에서 정한 ‘신약’에 해당하지 않아 신물질을 유효 성분으로 하여 최초로 품목허가를 받은 의약품으로 인정할 수 없다는 등의 이유로 거절결정을 한 사안에서, 구 특허법(2014. 6. 11. 법률 제12753호로 개정되기 전의 것, 이하 같다) 제89조 제1항 , 특허법 시행령 제7조 제1호의 문언적 의미를 중심으로 구 특허법의 입법 취지와 목적, 위임의 취지, 개정 연혁 등을 종합적으로 고려하면, 특허권의 존속기간 연장등록출원 대상이 되는 발명의 하나로 특허법 시행령 제7조 제1호 에서 정한 의약품은 기존에 허가된 의약품의 치료효과와 상이한 치료효과를 갖는 동시에 ‘기존에 허가된 의약품과 비교하여 필와 같은 치료효과를 나타내는 부분의 화학 구조가 새로운 물질’을 유효성분으로 하여 제조한 것으로서 최초로 품목허가를 받은 의약품으로 보아야 하는바, 위 의약품은 기존에 품목허가를 받은 의약품들과 상이한 만성손 습진 치료효과를 갖는 동시에 ‘기존에 허가된 의약품들과 비교하여 위와 같은 치료효과를 나타내는 부분의 화학구조가 새로운 물질’을 유효성분으로 하여 제조한 것으로서 최초로 품목허가를 받은 의약품이어서, 연장대상 특허발명은 이를 실시하기 위하여 구 약사법에 따른 품목허가를 받아야 하고 그 허가를 받기 위해 필요한 활성⋅안전성 등의 시험에 장기간이 소요되는 ‘위 시행령이 정하는 발명’에 해당함에도, 위 의약품이 구 약사법상 ‘신약’에 해당하지 않는다는 이유로 연장출원을 거절한 것은 위법하다고 한 사례.
참조법령
구 특허법(2014. 6. 11. 법률 제12753호로 개정되기 전의 것) 제89조 제1항 , 특허법 시행령 제7조 제1호 ,
구 약사법(2013. 7. 30. 법률 제11985호로 개정되기 전의 것) 제2조 제8호 , 제42조
전 문
【원 고】 글△▣▣그룹 리미티드(G△▽×o Group Limited) (소송대리인 변호사 박민정 외 2인)
【피 고】 특◇청장
【변론종결】 2017. 11. 14.
【주 문】
1. 특허심판원이 2016. 9. 23. 2014원5801호 사건에 관하여 한 심결을 취소한다.
2. 소송비용은 피고가 부담한다.
【청구취지】
주문과 같다.
【이 유】
1. 기초 사실
가. 이 사건 특허발명
1) 명칭: 9-시스 레티노산의 제조 방법
2) 국제출원일/ 우선권주장일/ 등록일/ 등록번호: 2004. 4. 2./ 2003. 4. 11./ 2007. 7. 20./(등록번호 생략)
3) 특허권자: 원고
4) 청구범위
하기 화학식 I의 3-메틸-4-옥소크로톤산의 알칼리 금속 염을 염기의 존재하에서 하기 화학식 II의 C15-트라이페닐포스포늄 염의 (Z)-이성질체와 반응시킴을 포함하고, 이때, 상기 화학식 I의 3-메틸-4-옥소크로톤산의 알칼리 금속 염이 동일 반응계에서 수산화알칼리의 존재하에 알킬-3-메틸-4-옥소크로토네이트로부터 가수분해되어 생성되는 것을 특징으로 하는, 9-(Z)-레티노산의 제조 방법:
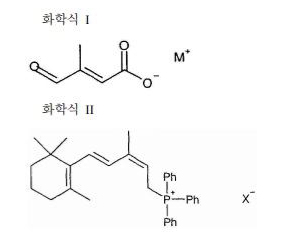
상기 식들에서,
M은 나트륨 또는 칼륨이고,
X는 할로겐이다.
[청구항 2, 11, 12] 삭제
[청구항 3~10] 별지 참조
나. 의약품 제조 • 판매 품목허가
1) 허가 일자: 2013. 4. 15.
2) 허가 내용: 약사법 제42조 의 규정에 의한 의약품 수입 품목허가(이하 ‘이 사건 품목허가’라 한다)
3) 유효성분: 9-시스 레티노산(9-cis retinoic acid)
4) 품목명: 알리트레티노인(Alitretinoin)
5) 제품명: 알리톡연질캡슐10밀리그램(이하 ‘이 사건 의약품’이라 한다)
6) 효능 및 효과: 최소 4주간의 강력한 국소 스테로이드 치료에도 반응하지 않는 성인의 재발성 만성 중증 손 습진
다. 이 사건 연장출원 및 거절결정
1) 원고는 2013. 7. 15. 이 사건 품목허가를 위하여 458일이 소요되었음을 이유로 이 사건 특허발명 중 청구항 제1, 3 내지 10항(이하 ‘이 사건 연장대상 특허발명’이라 한다)을 ‘연장대상 청구항’으로 하는 특허권의 존속기간 연장등록출원을 하였다(출원번호 생략, 이하 ‘이 사건 연장출원’이라 한다).
2) 특허청 심사관은 2013. 11. 12. 이 사건 연장출원에 대하여 “이 사건 의약품의 허가 이전에 이미 위 품목과 주성분(트레티노인 )이 동일한 베사노이드연질캅셀, 스티바에이액, 레타크닐크림 등에 대한 허가가 있어서, 이 사건 의약품은 신물질을 유효성분으로 하여 최초로 품목허가를 받은 의약품으로 인정될 수 없으므로, 이 사건 특허발명은 연장등록출원 대상이 되는 의약품 발명에 해당하지 않는다. 또한 연장신청 기간이 이 사건 특허발명을 실시할 수 없었던 기간을 초과한다.”는 이유로 의견제출통지를 하였다.
3) 한편 원고는 2014. 4. 14. 연장등록 신청기간을 457일로 정정하는 보정서를 제출하면서, “이 사건 의약품의 유효성분인 알리트레티노인은 트레티노인과 비교하여 약효를 나타내는 활성부분의 화학구조가 새로운 물질이므로 신물질로 인정되어야 한다.”는 취지의 의견서를 제출하였다.
4) 이에 대하여 특허청 심사관은 2014. 8. 18. “이 사건 의약품은 약사법 제2조 제8호 에서 정한 ‘신약’에 해당하지 않아 연장등록출원의 대상이 아니므로, 의견제출통지상의 거절이유가 해소되지 않았다.”는 이유로 거절결정을 하였다.
라. 이 사건 심결의 경위
1) 원고는 2014. 9. 17. 특허심판원 2014원5801호로 위 거절결정에 대한 불복심판을 청구하였다.
2) 특허심판원은 2016. 9. 23. 아래와 같은 이유 등을 들어 원고의 심판청구를 기각하는 이 사건 심결을 하였다.
이 사건 의약품은 알리트레티노인을 활성성분으로 포함하고 2013. 4. 15.에 허가를 받 았는데, 위 제품의 허가 이전에 트레티노인을 포함하는 베사노이드연질캅셀 등이 허가 되어 있었다. 살피건대, 알리트레티노인은 ‘9-시스 레티노산’이고 트레티노인은 ‘올-트랜스 레티노 산’이므로 알리트레티노인과 트레티노인은 서로 기하이성질체 관계에 있는 물질이고, 9- 시스 레티노산과 올-트랜스 레티노산은 회전이 자유로운 단일 결합을 포함하고 있어 RAR에 결합하는 공통된 성질을 갖고 있는바, 알리트레티노인과 트레티노인의 약효를 나타내는 활성부분의 화학구조가 다르다고 할 수 없다. 또한 레티노산은 비타민 A의 대사체로서 인체 내에서 올-트랜스, 13-시스 또는 9-시스 레티노산의 이성질체로서 존재하고 각 이성질체가 서로 전환되므로, 9-시스 레티노산의 경우 그 약효를 나타내는 활성부분의 구조는 결국 올-트랜스 레티노산과 동일하다고 하겠다. 식품의약품안전처(이하 ‘식약처’라 한다)의 허가 관련 사항을 살펴보아도, 이 사건 의 약품뿐만 아니라 레티노산의 모든 이성질체는 신약으로 허가되지 않았다는 것이 확인 되는데, 이로부터 레티노산이 비타민 A의 대사체로 생체 내에 존재하는 물질이어서 식약처의 허가 과정에서 신물질로 인정되지 않았음을 의미한다고 볼 수 있다. 그리고 올-트랜스
레티노산이 생체 내에서 9-시스 레티노산으로 이소머화(isomerization) 되는 것으로 알려져있고, 이 사건 의약품이 허가되기 오래 전에 올-트랜스 레티노산이 허가되어 시판되고 있었으므로, 알리톡의 허가를 위하여 장기간이 소요되어 이 사건 특 허발명이 일반적인 발명에 비하여 실시할 수 없었던 기간이 불합리하게 단축되었다고 할 수 없다. 따라서 이 사건 의약품은 약효를 나타내는 활성부분의 화학구조가 새로운 신물질을 활성성분으로 포함하는 것으로 인정되지 않으므로, 결국 이 사건 특허발명은 특허법 시 행령 제7조의 특허권 존속기간 연장등록출원대상 발명에 해당하지 않는다고 할 것이다.
마. 관계 법령
1) 구 특허법(2014. 6. 11. 법률 제12753호로 개정되기 전의 것, 이하 같다)
■ 제89조(허가 등에 따른 특허권의 존속기간의 연장)
① 특허발명을 실시하기 위하여 다른 법령의 규정에 의하여 허가를 받거나 등록 등을 하여야하고, 그 허가 또는 등록 등(이하 ‘허가 등’이라 한다)을 위하여 필요한 활성 • 안전성 등의 시험으로 인하여 장기간이 소요되는 대통령령이 정하는 발명인 경우에는 제88조 제1항의 규정에 불구하고 그 실시할 수 없었던 기간에 대하여 5년의 기간내에서 당해 특허권의 존속기간을 연장할 수 있다(이하 ‘이 사건 위임 조항’이라 한다).
2) 특허법 시행령(2013. 4. 3. 대통통령 제24491호로 개정된 것)2)
■ 제7조(허가 등에 따른 특허권의 존속기간의 연장등록출원 대상 발명) 법 제89조 제1항에서 “대통령령이 정하는 발명”이란 다음 각호의 어느 하나에 해당하는 발명을 말한다.
1. 특허발명을 실시하기 위하여「약사법」제31조 제2항, 제3항 또는 제42조 제1항에 따라 품목허가를 받아야 하는 의약품[신물질(약효를 나타내는 활성부분의 화학구조가 새로운 물질을 말한다. 이하 이 조에서 같다)을 유효성분으로 하여 제조한 의약품으로서 최초로 품목허가를 받은 의약품으로 한정한다]의 발명(이하 ‘이 사건 시행령 조항’이라 한다)
2. 특허발명을 실시하기 위하여「농약관리법」제8조 제1항, 제16조 제1항 및 제17조 제1항에 따라 등록하여야 하는 농약 또는 원제의 발명
3) 구 약사법(2013. 3. 23. 법률 제11690호로 개정된 것, 이하 같다)
■ 제2조(정의) 이 법에서 사용하는 용어의 뜻은 다음과 같다.
8. “신약”이란 화학구조나 본질 조성이 전혀 새로운 신물질 의약품 또는 신물질을 유효성분으로 함유한 복합제제 의약품으로서 식품의약품안전처장이 지정하는 의약품을 말한다.3)
■ 제31조(제조업 허가 등)
① 의약품 제조를 업으로 하려는 자는 대통령령으로 정하는 시설기준에 따라 필요한 시설을 갖추고 총리령으로 정하는 바에 따라 식품의약품안전처장의 허가를 받아야 한다.
⑪ 제1항부터 제4항까지 및 제9항에 따른 의약품 등의 제조업 • 위탁제조판매업 및 제조판매 품목의 허가 또는 신고를 할 때 허가 또는 신고의 대상 • 기준 • 조건 및 관리 등에 관하여 필요한 사항은 총리령으로 정한다.
■ 제42조(의약품 등의 수입허가 등)
① 의약품 등을 수입하려는 자(이하 ‘수입자’라 한다)는 총리령으로 정하는 바에 따라 품목마다 식품의약품안전처장의 허가를 받거나 신고를 하여야 한다. 허가받은 사항 또는 신고한 사항을 변경하려는 경우에도 또한 같다.
④ 제1항에 따라 수입되는 의약품 등 또는 그 수입자에 관하여는 제31조 제7항 • 제10항 • 제 11항을 준용한다. 이 경우 “제조” 또는 “생산”은 각각 “수입”으로, “제조업자” 또는 “품목허가를 받은 자”는 각각 “수입자”로 본다.
⑤ 제1항에 따른 의약품 등의 수입 품목 허가 또는 신고의 대상 • 기준 • 조건 및 관리 등에 필요한 사항은 총리령으로 정한다.
4) 의약품의 품목허가 • 신고 • 심사 규정(2013. 4. 3. 대통통령 제24491호로 개정된 것)
■ 제1조(목적) 이 고시는「약사법」제31조, 제35조, 제42조, 제76조에 따라 의약품의 제조판매품목허가 또는 신고, 의약품의 수입품목허가 또는 신고, 의약품의 안전성 • 유효성과 기준 및 시험방법의 심사에 있어 대상품목, 자료의 종류 • 작성 요령 • 요건 • 면제범위, 기준 및 관리등에 관한 세부사항을 규정함을 목적으로 한다.
■ 제2조 (정의) 이 규정에서 사용하는 용어의 정의는 다음 각호와 같다.
1. “유효성분”이란 내재된 약리작용에 의하여 그 의약품의 효능 • 효과를 직접 또는 간접적으로 발현한다고 기대되는 물질 또는 물질군(약리학적 활성성분 등이 밝혀지지 아니한 생약 등을 포함한다)으로서 주성분을 말한다.
7. “신약”이란「약사법」제2조 제8호에 따른 의약품으로서 국내에서 이미 허가된 의약품과는 화학구조 또는 본질 조성이 전혀 새로운 신물질 의약품 또는 신물질을 유효성분으로 함유한 복3)합제제 의약품으로서 [별표 1]의 의약품의 종류 및 제출자료의 범위 중 Ⅰ에 해당하는 의약품을 말한다. 다만「대한민국약전」(식품의약품안전처 고시) 또는 [별표 1의2]에 따라 식품의약품안전처장이 인정하는 공정서 및 의약품집에 수재된 품목은 제외한다.
8. “안전성 • 유효성심사 자료제출의약품(이하 ‘자료제출의약품’이라 한다)”이란 신약이 아닌 의약품이면서 이 규정에 의한 안전성 • 유효성 심사가 필요한 품목으로서 [별표 1]의 의약품의 종류 및 제출자료의 범위 중 Ⅱ에 해당하는 의약품4)을 말한다.
[인정 근거] 다툼 없는 사실, 갑 제1 내지 4, 6호증, 을 제1, 2, 13호증의 각 기재, 변론 전체의 취지
2. 당사자들의 주장
가. 원고 주장의 요지
아래와 같은 이유로 이 사건 연장출원을 거절한 거절결정을 그대로 유지한 이 사건 심결은 위법하므로 취소되어야 한다.
1) 이 사건 시행령 조항의 개정 취지는, 기존 허가에 의해 특정 유효성분의 활성 및 안전성이 이미 확인된 경우 ‘그 유효성분을 포함하면서 용도 또는 제형을 변경하거나 치료 대상만을 변경한 후속 허가’에 기한 특허권의 존속기간 연장을 배제하는 등 연장등록출원 대상을 특허법 고유의 체계에서 별도로 규율하기 위한 것이지, 기존 허가에 의해 활성 및 안전성이 확인된 바 없는 새로운 이성질체 의약품에 기초한 존속기간 연장까지 배제하거나 특허권 존속기간 연장 대상을 약사법상 “신약” 발명으로 한정하기 위한 것이 아니다. 결국 존속기간 연장등록출원의 기초가 되는 의약품이 “신물질”을 유효성분으로 포함하고 있는지 여부는 구 약사법 제2조 제8호 의 “신약”의 정의에 따라 판단할 것이 아니라 이 사건 시행령 조항에 기재된 “신물질”의 정의에 따라 판단되어야 한다.
2) 그런데 이 사건 연장출원의 기초가 된 이 사건 의약품의 유효성분인 알리트레티노인은 기존에 허가된 제품의 유효성분인 트레티노인과 대비하여 화학구조가 다르고, 이러한 구조적 차이로 인해 결합하는 수용체의 종류에 차이가 있으며, 임상적 약효 역시 상이하다.
또한 이 사건 의약품은 기존에 허가된 제품의 임상시험과는 별도로 총 14건의 임상 시험을 실시하여 허가에 필요한 안전성 • 유효성 자료를 구비한 상태에서 이 사건 품목허가를 받았다.
3) 따라서 알리트레티노인은 이 사건 시행령 조항에서 규정하고 있는 “약효를 나타내는 활성부분의 화학구조가 새로운 물질(신물질)”에 해당하는 것이 명백하다.
나. 피고 주장의 요지
아래와 같은 이유로 이 사건 연장출원은 거절되어야 한다.
트레티노인은 모두 RAR5) 에 결합하여 작용하는 공통된 성질 및 약효를 나타내며, 경구투여 후에는 서로 다른 두 개의 이성질체로 대사되어 3개의 이성질체(9-시스 레티노산, 트레티노인, 이소트레티노인6) )가 동시에 혈액에 존재하므로, 약효를 나타내는 활성부분의 화학구조가 다르다고 할 수 없다.
3. 이 사건 심결의 위법 여부
가. 이 사건 시행령 조항의 해석
1) 해석의 방법
법은 원칙적으로 불특정 다수인에 대하여 동일한 구속력을 갖는 사회의 보편타당한 규범이므로 이를 해석함에 있어서는 법의 표준적 의미를 밝혀 객관적 타당성이 있도록 하여야 하고, 가급적 모든 사람이 수긍할 수 있는 일관성을 유지함으로써 법적 안정성이 손상되지 않도록 하여야 한다. 한편 실정법은 보편적이고 전형적인 사안을 염두에 두고 규정되기 마련이므로 사회현실에서 일어나는 다양한 사안에서 그 법을 적용함에 있어서는 구체적 사안에 맞는 가장 타당한 해결이 될 수 있도록 해석할 것도 또한 요구된다. 요컨대 법해석의 목표는 어디까지나 법적 안정성을 저해하지 않는 범위 내에서 구체적 타당성을 찾는 데 두어야 한다. 나아가 그러기 위해서는 가능한 한 법률에 사용된 문언의 통상적인 의미에 충실하게 해석하는 것을 원칙으로 하면서, 법률의 입법 취지와 목적, 그 제 • 개정 연혁, 법질서 전체와의 조화, 다른 법령과의 관계 등을 고려하는 체계적 • 논리적 해석방법을 추가적으로 동원함으로써, 위와 같은 법해석의 요청에 부응하는 타당한 해석을 하여야 한다( 대법원 2013. 1. 17. 선고 2011다83431 전원합의체 판결 등 참조).
2) 구체적 해석
가) 개정 연혁
(1) 특허법이 1986. 12. 31. 법률 제3891호로 개정되면서 존속기간 연장신청 제도가 처음으로 도입되었고, 특허법이 1990. 1. 13. 법률 제4207호로 개정되면서 존속기간 연장등록출원 제도로 변경됨과 동시에 조문의 위치가 제89조 로 변경되었으며, 이후 특허법에서 2년 미만 하한 규정이 삭제되는 등 수차례 변경이 있었으나, 구 특허법에 이르기까지 대체로 “다른 법령의 규정에 의한 허가 • 등록 등(이하 ‘허가 등’이라 한다)을 위하여 활성 • 안전성 등의 시험으로 인하여 장기간이 소요되는 대통령령이 정하는 발명”인 경우에 존속기간을 연장해 주는 것으로 존속기간 연장 요건이 규정되어 왔다.
(2) 한편 존속기간 연장신청 제도가 도입될 당시의 특허법 시행령 이후 대체로 특허법의 위임에 따른 “대통령이 정하는 발명”으로 “특허발명을 실시하기 위하여 약사법에 따라 품목허가를 받아야 하는 의약품의 발명”등을 규정하고 있다가, ‘이 사건 시행령 조항’에서 비로소 위 의약품의 의미를 보다 구체적으로 “신물질(약효를 나타내는 활성부분의 화학구조가 새로운 물질을 말한다)을 유효성분으로 하여 제조한 의약품으로서 최초로 품목허가를 받은 의약품으로 한정한다.”라고 규정하게 되었다.
이 사건 시행령 조항의 개정 과정에서 구 약사법의 ‘신약’의 정의 규정과 극히 유사한 취지로 ‘신물질’을 정의하는 내용이 포함된 특허법 시행령8)이 입법 예고되었으나(을 제7호증의 1, 2, 제8호증의 1, 2), 실제 개정은 입법 예고된 내용과 다르게 이루어졌다(피고는 위 개정안의 심사를 법제처에 의뢰하는 등 소관 부서의 위치에 있었음에도 위와 같이 입법 예고와 다르게 개정이 이루어진 경위에 관하여 아무런 자료도 제출하지 않고 있다).
나) 법률의 입법 취지와 목적
(1) 존속기간 연장 제도가 처음으로 도입된 1986. 12. 31. 제3891호로 개정된 특허법 개정과정에서의 설명자료, 심사보고서 등에는 입법 취지와 목적을 추단할 수 있는 아래와 같은 기재가 있다.
기술의 전문화 • 복잡화에 따라 하나의 발명을 완성 • 실시하는 데 점점 더 많은 연구 • 개발비용과 오랜 기간을 필요로 하고 있을 뿐만 아니라 안전, 공해방지 등 제품에 대한 각종 규제가 강화되고 있어, 발명을 실용화하는 데 소요되는 기간이 점차 길어져 특허 를 받은 발명자가 실제 그 특허품을 시장에서 판매하여 발명 노력의 대가를 받을 수 있는 기간이 상대적으로 짧아지고 있기 때문에, 특허품 수요자의 이익을 크게 해치지 않는 한도 내에서 현재 12년으로 되어있는 특허기간을 국제적인 일반 관례대로 15년 으로 연장하고, 특허존속기간회복제도를 새로이 도입함으로써 발명자의 보호가 한층 강 화될 것으로 생각됨.
(2) 위와 같은 법률의 입법 취지와 목적을 감안하면, 구 특허법이 마련한 존속기간 연장제도는, 특허권의 존속기간 중 특허발명을 실시하기 위하여 법령에 따른 허가 등을 받아야 하고 이에 필요한 시험 등으로 인하여 장기간이 소요되는 발명에 대하여 5년의 범위 내에서 특허발명을 실시하지 못한 기간만큼 존속기간을 연장시켜주는 제도이다. 의약품 • 농약 등의 발명의 경우 발명을 실시하기 위하여 안전성 및 유효성 확보를 목적으로 하는 약사법 또는 농약관리법 등에 따라 규제당국의 허가 • 등록 등을 받아야 하는데, 이를 위하여 필요한 시험 • 심사 등에 장기간이 소요된다. 이로 인해 특허권자로서는 특허권이 존속하고 있음에도 위 기간 동안에는 특허발명을 실시하지 못하고 특허권에 기한 이익을 누릴 수 없는 불이익을 입게 되는데, 이는 다른 산업 분야의 특허권과 비교하여 형평성에 반한다. 그리하여 구 특허법 제89조 는 위와 같은 불합리를 해소하고 의약품 등의 발명을 보호 • 장려함으로써 기술발전을 촉진시키기 위하여 5년의 기간 범위 내에서 허가 등을 받기 위하여 특허발명을 실시할 수 없었던 기간만큼 특허권의 존속기간을 연장해 주도록 한 것이다.
다) 위임의 취지
(1) 존속기간 연장등록출원의 대상이 되는 특허발명을 확정하는 기준은 고도의 전문적 • 기술적 사항에 속하고, 기술발전이나 시대상황 등에 능동적 • 탄력적으로 대응하기 위하여 그 내용을 개정할 필요가 있으므로, 이 사건 위임 조항은 위 기준의 구체적 • 세부적 내용을 법률에 직접 규정하는 대신 하위법령에 위임한 것이다.
다만 이 사건 위임 조항은 연장등록을 받을 수 있는 특허발명의 범위를 “허가 등을 위하여 필요한 활성 • 안전성 등의 시험으로 인하여 장기간이 소요되는 발명”으로 한정하였다.
(2) 이와 같은 이 사건 위임 조항의 입법 취지와 목적 및 규정 내용 • 형식에 비추어 볼 때, 이 사건 위임 조항의 수권범위를 해석함에 있어서는 허가 등을 위한 활성 • 안전성 등의 시험으로 인하여 장기간이 소요되는지 여부가 문제 될 뿐 구 약사법상 ‘신약’인지 여부가 절대적인 기준이 된다고 할 수 없다. 즉 일반적으로 ‘신약’ 발명의 경우 다른 의약발명에 비하여 임상시험, 심사 등에 더 장기간이 소요되고 출원 이후에도 허가 등을 위하여 지속적인 개발이 필요하다고 하더라도, 이 사건 위임 조항의 입법 취지와 목적 및 규정 내용 • 형식을 감안하면, 이러한 사정을 근거로 이 사건 위임 조항의 수권범위가 ‘신약’ 발명으로 한정된다고 해석할 수 없다.
(3) 존속기간 연장 제도가 도입된 이후 ‘신약’으로 지정되어 연장 승인 • 등록된 제품의 경우에도 연장된 기간이 1년 미만인 경우도 상당수 존재하는 점(갑 제25 내지 28호증, 제29호증의 1 내지 3), 기하이성질체인 이 사건 의약품에 대하여 식약처에서 484일간의 심사가진행된 점 등을 고려할 때, ‘활성 • 안전성 등의 시험으로 인하여 소요되는 기간’이 신약의 경우에만 장기간이라고 단정하기 어려운바, 이러한 사정 역시 이 사건 위임 조항의 수권범위를 ‘신약’ 발명으로 한정할 수 없는 이유가 된다.
라) 문언의 통상적인 의미
(1) 이 사건 시행령 조항에서는 존속기간 연장의 대상이 되는 발명의 하나로 ‘“약효를 나타내는 활성부분의 화학구조가 새로운 물질”인 신물질을 유효성분으로 하여 제조한 의약품으로서 최초로 품목허가를 받은 의약품에 관한 발명’을 규정하고 있다.
그런데 ‘신물질’의 정의에 관한 위와 같은 규정은 구 약사법 제2조 의 신약의 정의(“신약이란 화학구조나 본질 조성이 전혀 새로운 신물질 의약품 또는 신물질을 유효성분으로 함유한 복합제제 의약품으로서 식품의약품안전처장이 지정하는 의약품을 말한다”)와 문언상 일치하지 않는 것이 명백하다.
한편 의약품의 품목허가 • 신고 • 심사 규정에서는 위 구 약사법과 유사한 취지로 신약을 정의하면서( 제2조 제7호 ), ‘유효성분’의 의미를 “내재된 약리작용에 의하여 그 의약품의 효능 • 효과를 직접 또는 간접적으로 발현한다고 기대되는 물질 또는 물질군(약리학적 활성성분 등이 밝혀지지 아니한 생약 등을 포함한다)으로서 주성분을 말한다.”라고 규정하고 있다( 제2조 제1호 ).
(2) 의약 분야에서 ‘약효를 나타내는 활성부분’의 의미에 대하여 일반적으로 정립된 개념은 없는 것으로 보인다.
(3) 한편 존속기간 연장의 대상적격이 될 수 있는지가 문제되는 의약9) 발명에는 ‘의약용도 발명’( 대법원 2014. 5. 16. 선고 2012후3664 판결 등), ‘선택발명’( 대법원 2014. 5. 16. 선고 2012후3664 판결 등), ‘이성질체 발명’( 대법원 2003. 10. 24. 선고 2002후1935 판결 등), ‘염(鹽)발명’, ‘결정형 발명’( 대법원 2011. 7. 14. 선고 2010후2865 판결 등), ‘제형발명’( 대법원 2011. 10. 13. 선고 2009후4322 판결 ), ‘투여용법 내지 투여용량을 구성요소로 하는 의약용도 발명’( 대법원 2015. 5. 21. 선고 2014후768 전원합의체 판결), ‘제법발명’ 등이 있다.
의약용도발명은 특정 물질(활성성분, 이하 ‘활성성분’이라 한다)이 특정 질병에 대한 치료효과를 갖는 것을 핵심적인 기술사상으로 하면서, 활성성분과 그것이 가지고 있는 의약용도가 발명을 구성하게 되는데( 대법원 2014. 5. 16. 선고 2012후3664 판결 등 참조), 활성성분의 하위개념인 화합물을 청구범위로 하는 선택발명, 활성성분의 광학 • 기하이성질체를 청구범위로 하는 이성질체 발명, 동일한 활성성분에 다른 염을 부가하는 염발명, 활성성분과 결정 형태만을 달리하는 결정형 발명, 새로운 의약용도를 구성요소로 하는 제2 의약용도 발명, 투여용법 내지 투여용량을 추가적인 구성요소로 하는 용법 • 용량 발명 등의 경우에도 활성성분이 특정 질병에 대한 치료효과를 갖는다는 기술사상을 공통적으로 갖고 있다.
한편 의약발명에 있어서는 활성성분과 특정 질병에 대한 치료효과만 밝혀지는 경우도 있고, 더 나아가 활성성분이 그와 같은 치료효과를 내기 위해 생체 내에서 일어나는 생리활성 작용으로서의 약리기전까지 밝혀지는 경우도 있다.
(4) 위와 같은 각 법령에서의 사용례와 의약발명에서의 활성성분의 의미를 참작하면, ‘약효를 나타내는 활성 부분의 화학구조가 새로운 물질’인 신물질은 피고 주장과 같이 구 약사법상의 신약으로 보기 보다는 의약품의 성분 중 내재된 약리작용에 의하여(약리기전이 밝혀지지 않은 경우도 있다) 특정 질병에 대한 치료효과를 나타내는 부분의 화학구조가 새로운 물질이라고 해석하는 것이 문리해석상 자연스러워 보인다.
마) 종합: 이 사건 시행령 조항의 해석
위와 같은 이 사건 위임 조항 및 이 사건 시행령 조항의 문언적 의미를 중심으로 구 특허법의 입법 취지와 목적, 위임의 취지, 개정 연혁 등을 종합적으로 고려하면, 이 사건 시행령조항에서의 의약품은 기존에 허가된 의약품의 치료효과와 상이한 치료효과를 갖는 동시에 ‘기존에 허가된 의약품과 비교하여 위와 같은 치료효과를 나타내는 부분의 화학구조가 새로운 물질’을 유효성분으로 하여 제조한 것으로서 최초로 품목허가를 받은 의약품으로 봄이 타당하다(다만 입법론적으로는 시행령에 규정될 장기간 소요되는 발명의 내용을 예시적으로 열거하거나, 장기간 소요되는 발명의 판단 기준에 관하여 구체적으로 설명하는 등의 방식으로 법률을 정비하여, 위임의 범위를 보다 명확하게 하는 것이 바람직하다).
나. 이 사건 의약품이 이 사건 시행령 조항에 해당하는지 여부
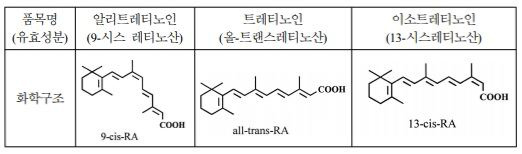
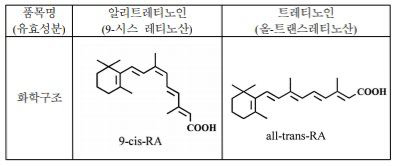
1) 이 사건 의약품의 유효성분인 9-시스 레티노산(9-cis retinoic acid)은 기존에 품목허가를 받은 의약품의 유효성분인 트레티노인, 이소트레티노인(을 제14호증)과 기하이성질체(幾何異性質體, geometrical isomer, 시스-트랜스 이성질체) 10)의 관계에 있다
이 사건 의약품의 유효성분은 기존에 품목허가를 받은 의약품의 유효성분들과 입체구조가 달라 화학구조가 다르다고 평가할 수 있다.
한편 기하이성질체는 입체구조가 서로 달라 일반적으로 이온화 등의 물리화학적 성질이 나 생물학적 활성에 있어 상당한 차이가 있다.
2) 더욱이 9-시스 레티노산(9-cis retinoic acid)은 트레티노인이 레티노이드 수용체11) 중 RAR에만 결합하는 것과 달리, RAR뿐만 아니라 RXR12) 에도 결합한다. 또한 레티노산(9-cisretinoic acid)은 트레티노인이 갖지 못한 만성 손 습진 치료효과를 갖고 있는데(갑 제5호증, 을 제14, 16, 17호증), 이러한 치료효과의 차이는 위와 같은 작용기전의 차이에서 기인한 것으로 보인다.
3) 따라서 비록 9-시스 레티노산과 트레티노인이 RAR에 결합하는 공통적인 성질을 갖고 있고, 이 사건 의약품이 인체에 투여되는 경우 트레티노인 등의 기하이성질체로 이성질체화(isomerization)될 수 있는 점을 감안하더라도, 앞서 살펴 본 기하이성질체의 일반적인 성질, 각 유효성분의 작용 및 효과의 차이에 비추어 보면, 이 사건 의약품은 기존에 품목허가를 받은 의약품들과 상이한 만성 손 습진 치료효과를 갖는 동시에 ‘기존에 허가된 의약품들과 비교하여 위와 같은 치료효과를 나타내는 부분의 화학구조가 새로운 물질’을 유효성분으
로 하여 제조한 것으로서 최초로 품목허가를 받은 의약품으로 봄이 타당하다.
다. 종합: 이 사건 심결의 위법 여부
따라서 이 사건 연장대상 특허발명은 이를 실시하기 위하여 구 약사법에 따른 품목허가를 받아야 하고 그 허가를 받기 위해 필요한 활성 • 안전성 등의 시험에 장기간이 소요되는 ‘이 사건 시행령이 정하는 발명’에 해당함에도, 피고가 이 사건 의약품이 신약에 해당하지 않는다는 이유로 이 사건 연장출원을 거절한 것은 위법하다.
4. 결론
그렇다면 이 사건 심결의 취소를 구하는 원고의 이 사건 청구는 이유 있어 이를 인용하기로 하여 주문과 같이 판결한다.
판사 김환수(재판장) 윤주탁 장현진 [별 지] 생략
1) 트레티노인의 유효성분 인 올-트랜스레티노산은 이 사건 의약품의 유효성분인 9-시스 레티노산(품목명: 알리트레티노인)과 기하이성질체(幾何異性質體) 관계에 있다(상세한 내용은 아래 3.의 나.항 참조).
2) 부칙 제2조(“제7조의 개정규정은 이 영 시행 이후 허가 등에 따른 특허권의 존속기간의 연장등록출원을 한 발명부터 적용한다.”)에 따라 위 시행령 시행일인 2013. 4. 3. 이후 출원된 이 사건 연장출원에 대하여는 위 시행령 제7조가 적용된다.
3) 이하 ‘신약’이라 한다.
4) [별표 1]에서는 자료제출의약품으로 “새로운 염을 유효성분으로 함유한 의약품”, “새로운 이성체를 유효 성분으로 함유한 의약품”, “새로운 효능군 의약품”, “유효성분의 새로운 조성 또는 함량만의 증감”, “새로운 투여경로 의약품”, “새로운 용법 용량 의약품”, “새로운 제형(동일투여경로)” 등을 규정하고 있다.
5) Retinoid A Receptor(RAR, 레티노이드 A 수용체)를 지칭한다.
6) 아래 3.의 나.항 참조.
7) 제53조(특허권의 존속기간)
① 특허권의 존속기간은 출원공고가 있은 경우에는 그 공고가 있은 날로부터, 출원공고가 없는 경우에는 특허 권설정의 등록이 있은 날로부터 15년으로 한다.
② 특◇청장은 제1항의 규정에 불구하고 특허발명을 실시하기 위하여 다른 법령에 의하여 허가를 받거나 등록을 하여야 하고 그 허가 또는 등록을 위하여 필요한 활성 • 안전성 등의 시험에 장기간이 소요되는 경우에는 5년의 기간 내에서 당해 특허권의 존속기간을 연장할 수 있다.
③ 제2항의 규정에 의하여 존속기간을 연장할 수 있는 특허발명의 대상 • 요건 기타 필요한 사항은 대통령령으로 정한다.
8) 특허법 시행령(1987. 7. 1. 대통령령 제12199호로 개정된 것) 제9조의2(특허권 존속기간의 연장승인)
① 법 제53조 제2항의 규정에 의하여 특허권의 존속기간(이하 “특허기간”이라 한다)을 연장할 수 있는 발명은 특허기간의 연장신청 당시 국내에서 실시 중인 발명 또는 실시준비가 완료된 발명으로서 다음 각호의 1에 해당하는 것에 한한다.
1. 특허발명을 실시하기 위하여 약사법 제26조 제1항의 규정에 의하여 품목허가를 받아야 하는 의약품의 발명
2. 특허발명을 실시하기 위하여 농약관리법 제8조 제1항 및 동법 제9조 제1항의 규정에 의하여 등록을 받아야 하는 농약 또는 농약원제의 발명
9) 사람이나 동물의 질병을 진단, 치료, 경감, 처치 또는 예방을 목적으로 사용하는 물질을 의미한다(구 특허법 제96조 제2항, 구 약사법 제2조).
10) 분자식은 같지만 원자의 배열이 달라 성질이 서로 다른 화합물을 ‘이성질체’라 한다. 이성질체는 분자식은 같지만 원자의 연결 순서(결합)가 다른 ‘구조이성질체’ 및 원자 사이의 연결 순서(결합)는 같지만 원자 또는 원자단(原子團)의 공간적 배치가 서로 다른 ‘입체이성질체’로 분류된다. 한편 입체 이성질체에는 기하이성질체, 분자식은 동일하지만 서로 거울상의 이미지를 가짐으로써 입체구조가 겹쳐질 수 없는 ‘광학이성질체(거울상 이성질체, enantiomer)’ 등이 있다. 기하이성질체는 탄소-탄소 이중결합 등에서 원자 또는 원자단이 고정된 구조나 결합 주위에서 위치를 달리함으로써 생긴다. 시스(cis) 형은 같은 종류의 원자나 원자단이 같은
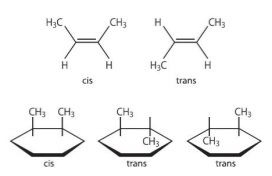
쪽에 있고, 트랜스(trans) 형은 서로 반대쪽에 있다(그림 참조).
11) 수용체(受容體, receptor): 세포막 또는 세포질에 존재하며, 세포 밖에서의 물질 또는 물리적 자극을 인식하여 세포에 특정한 반응을 일으키는 구조체를 의미한다. 그 본체는 단백질인데, 특정 물질을 인식하는 경우 특정한 부위에서 특이적으로 결합한다.
12) Retinoid X Receptor(RXR, 레티노이드 X 수용체)를 지칭한다.
 법무법인 다래
법무법인 다래